
その濃度により
分類され、その生成方法も
様々です。ここでは次亜塩素酸水溶液の主な
生成方法のほか、
パナソニックが研究を進めている
「気体状次亜塩素酸」についても
ご紹介します。


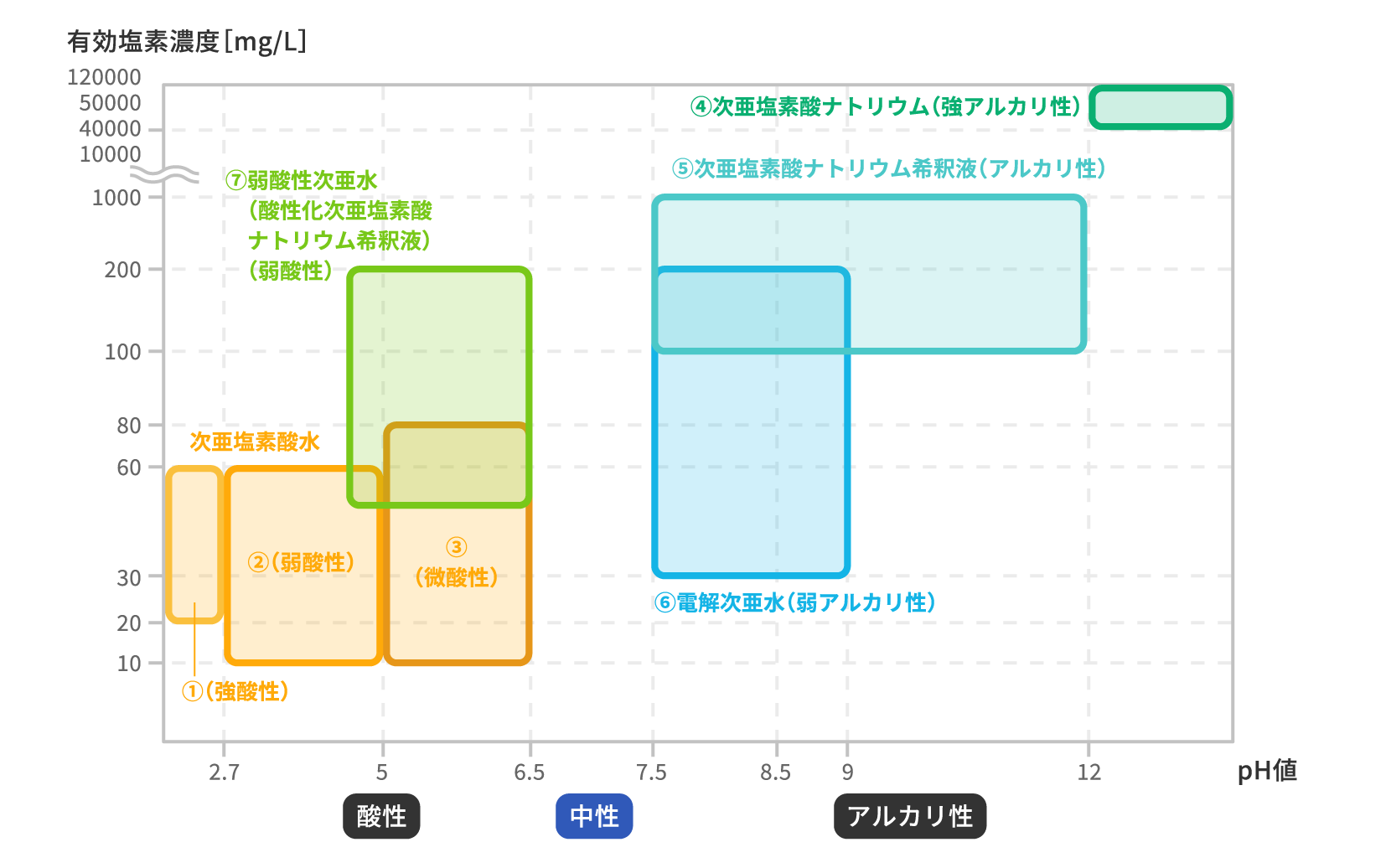
①次亜塩素酸水(強酸性)
厚生労働省認定 食品添加物(殺菌料)として指定
pH ≦2.7, 20~60 mg/L
②次亜塩素酸水(弱酸性)
厚生労働省認定 食品添加物(殺菌料)として指定
pH 2.7~5.0, 10~60 mg/L
③次亜塩素酸水(微酸性)
厚生労働省認定 食品添加物(殺菌料)として指定
pH 5.0~6.5, 10~80 mg/L
④次亜塩素酸ナトリウム
厚生労働省認定 食品添加物(殺菌料)として指定
濃度:40000 mg/L(4%)以上
(pH表示は一般的に使われることの多いpH 12以上としています)
⑤次亜塩素酸ナトリウム希釈液
④を希釈したもの、食品添加物(殺菌料)と同様に扱えます
pH 7.5以上、濃度:100~1000 mg/L
⑥電解次亜水
⑤と同類性あり、食品添加物(殺菌料)と同様に扱えます
pH 7.5以上
(濃度表示は一般的に使われることの多い30~200 mg/Lとしています)
⑦弱酸性次亜水
⑤を塩酸または二酸化炭素などで酸性側にpH調整したもの
pH・濃度に規定なし
(表示は一般的に使われることの多いpH 4~6.5、濃度:50~200 mg/Lとしています)
次亜塩素酸水(酸性)の生成方法です。生成方法によりpH値が変わり、強酸性・微酸性が生成出来ます。
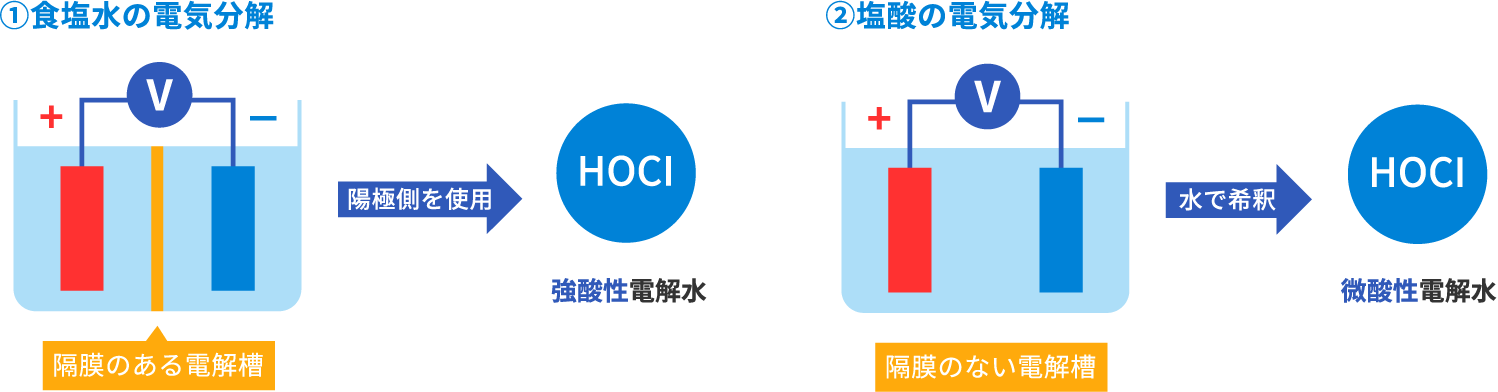

次亜塩素酸ナトリウム(アルカリ性)の生成方法です。
工業的大量生産技術により、水酸化ナトリウム水溶液に塩素ガスを溶解させ次亜塩素酸イオン(OCl-)を生成します。家庭用漂白剤などが該当するこの次亜塩素酸ナトリウムは、一般的に希釈して使用します。

※高濃度食塩水を隔膜のない電解槽で電解生成する方法もあります。
※次亜塩素酸ナトリウム(NaClO)と次亜塩素酸水(酸性電解水)は名前は似ていますが、液性(pH)が異なる
まったく別の物質です。次亜塩素酸ナトリウムを水で薄めても次亜塩素酸水にはなりません。

電解次亜水(弱アルカリ性)の生成方法です。食塩水を電気分解することで生成します。
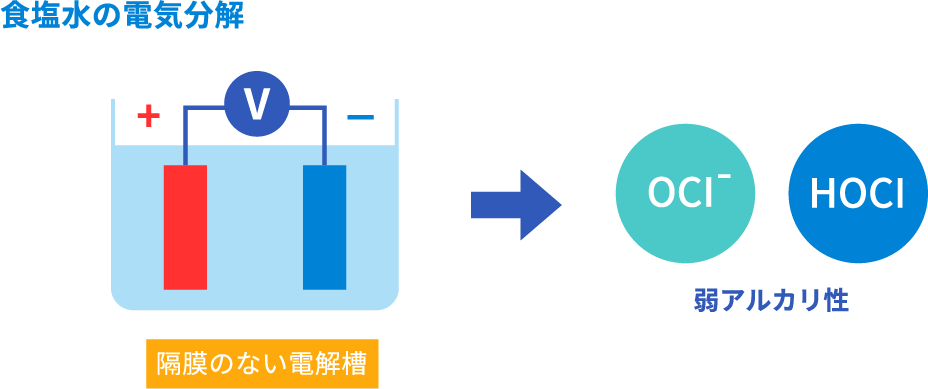
パナソニックが着目している除菌力と揮発性のバランスが取れた弱アルカリ性水溶液
(pH約8.5)は、電解次亜水と同じ生成方法です。


パナソニックは液体状の次亜塩素酸だけでなく、気体状次亜塩素酸の存在証明・効果も研究しています。
学会でも発表されている次亜塩素酸の研究成果をご紹介します。


空間中に揮発した遊離塩素の量を、純水に溶けた塩素イオン量から計測する。
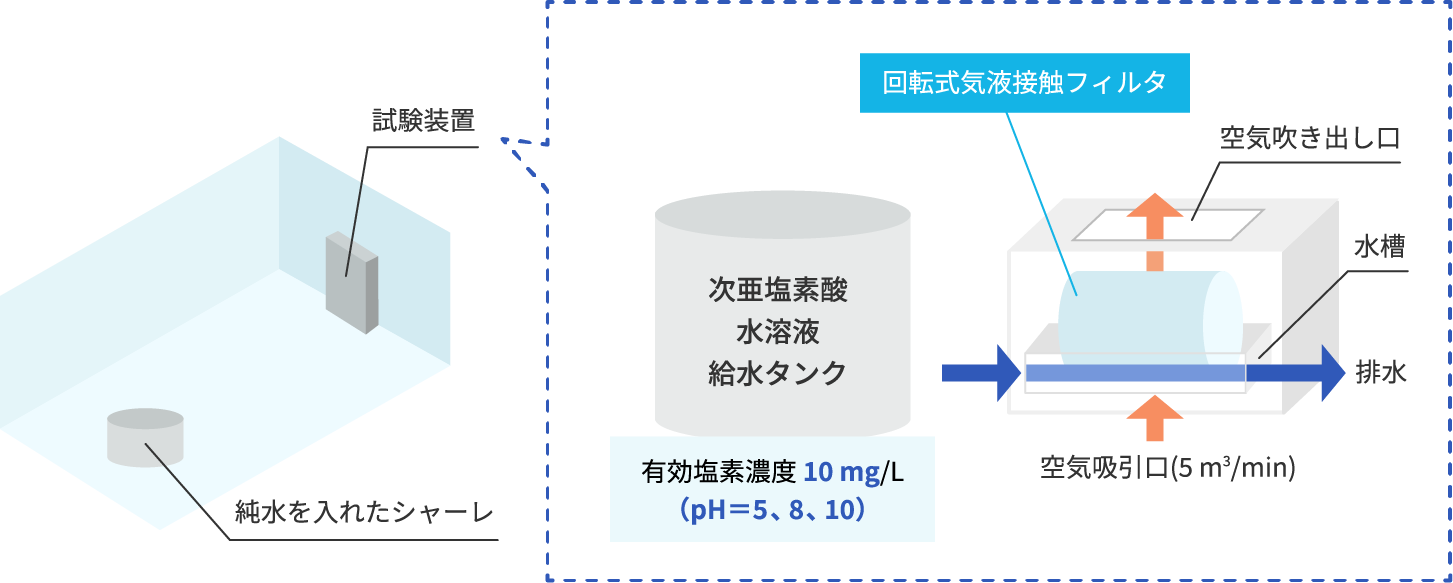

pHごとの遊離塩素量(部屋中央への遊離塩素到達量を塩素イオンとして定量)
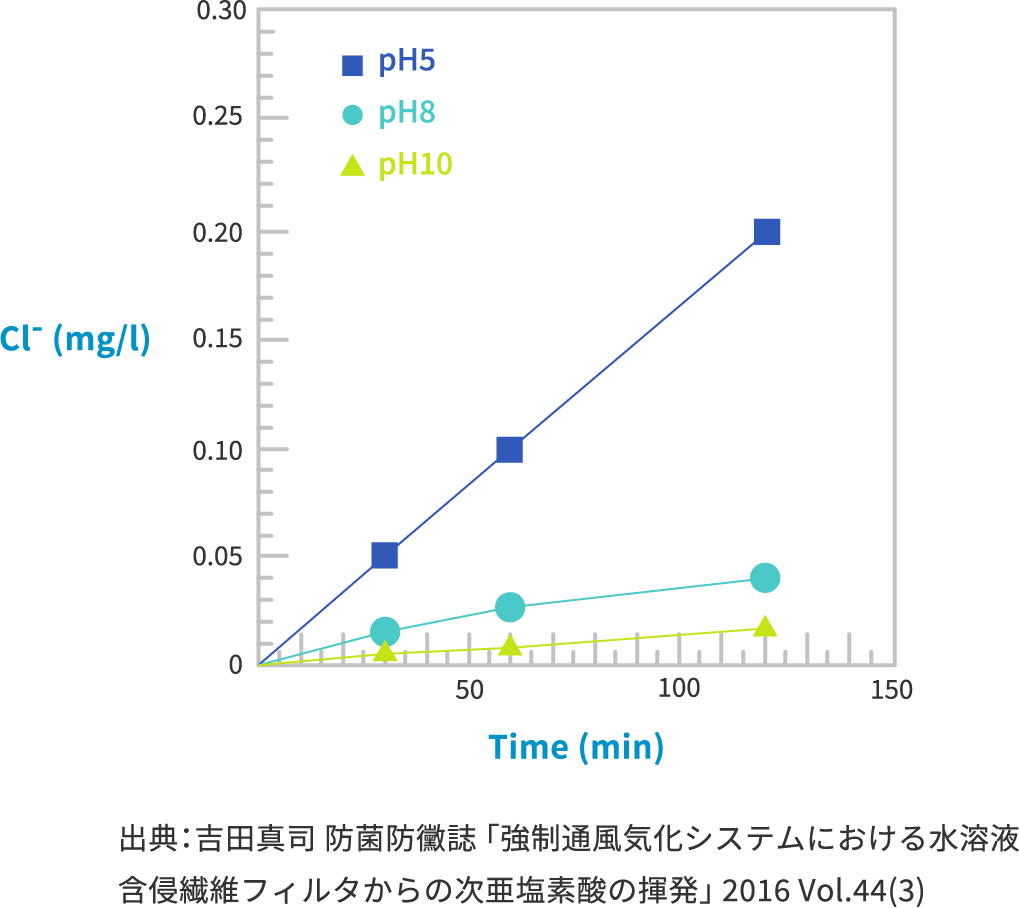
遊離塩素の揮発量は pH5>8>10
→
次亜塩素酸(HOCl)が揮発すると考えられる
【結論】
次亜塩素酸水溶液から遊離塩素が揮発していることを確認し、pHによって揮発量が違うことから、次亜塩素酸(HOCl)が揮発していることが示唆されました。

酸化力を有する有効塩素は、遊離塩素と結合塩素の二種類に分けられます。
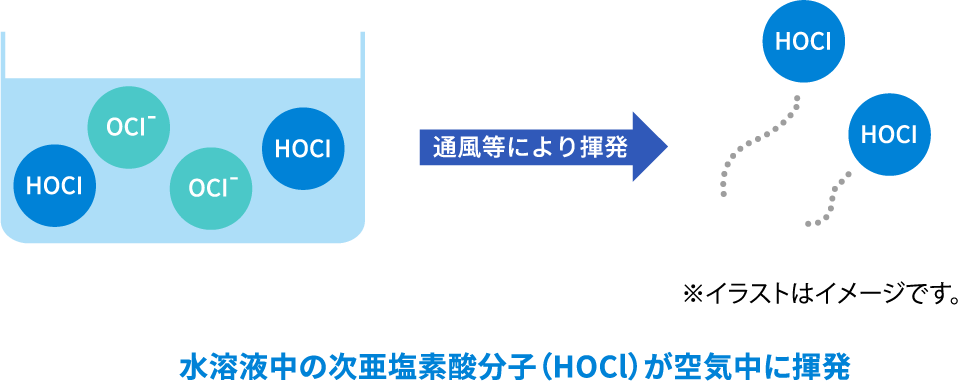
遊離塩素とは塩素の酸化数が+1か0で、無機・有機窒素と結合していない化学種、すなわちHOCl、OCl-、Cl2のことです。水溶液中では、Cl2はすぐ揮発またはイオン化して消失しますので、HOClとOCl-の2種類が存在します。
一方、結合塩素とは、上記の遊離塩素がアンモニアなどと反応してできる塩素化窒素化合物を言い、クロラミン(NH2Cl)などがあります。
遊離塩素は結合塩素より反応性が高く、すなわち除菌力が高くなります。
遊離塩素 > 結合塩素(独特のニオイ)
次亜塩素酸水溶液からは、イオン状態で存在するOCl-は揮発しないため、揮発成分は、次亜塩素酸(HOCl)と塩素(Cl2[強酸性領域のみ])となります。また、次亜塩素酸水溶液がアンモニアと反応して生成するクロラミンなども揮発します。そのため、揮発する次亜塩素酸(HOCl)だけでなく、結合塩素として揮発したクロラミンなども弱いながらも除菌効果を持ちます。

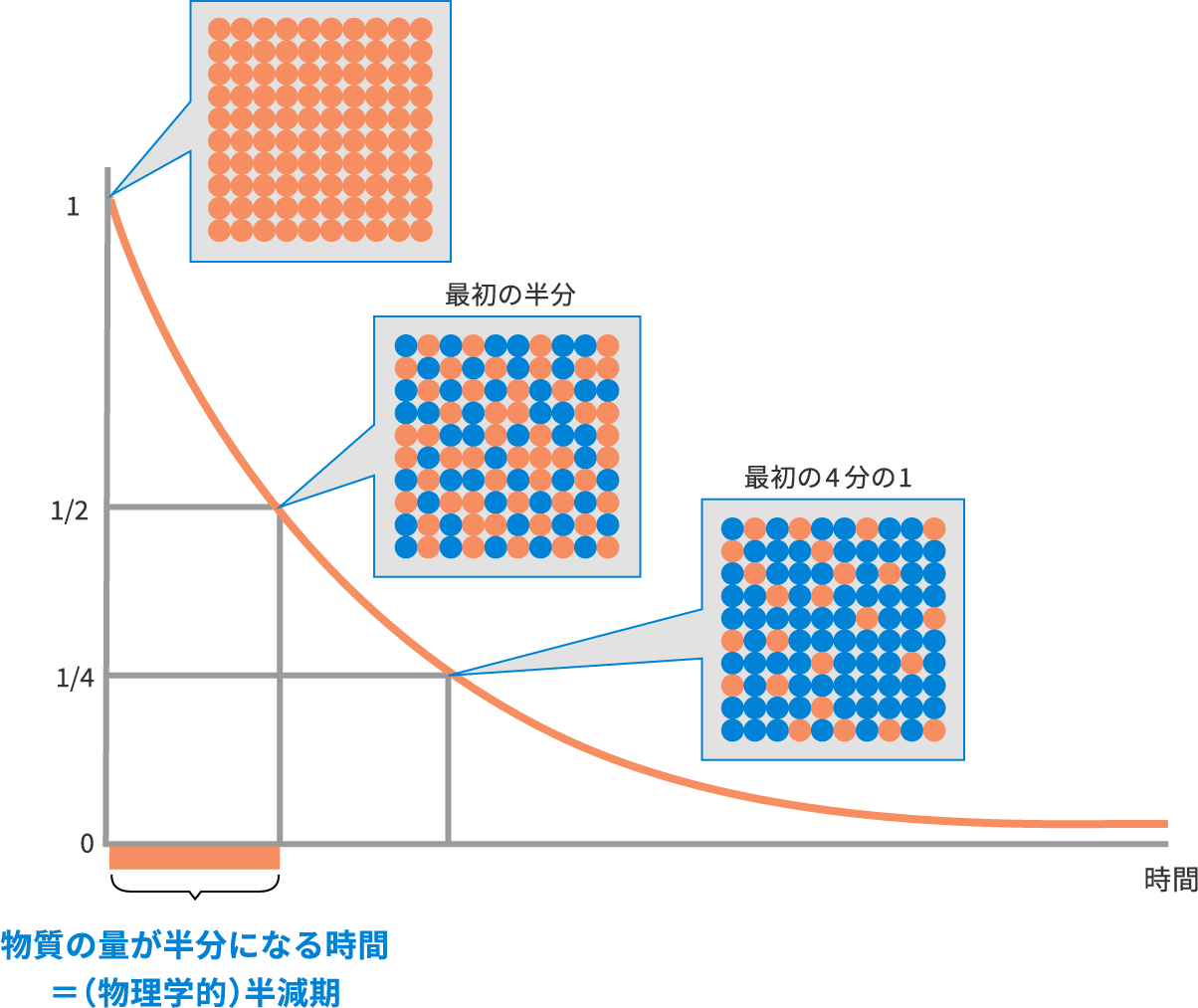
半減期とは、物質の量が半分になる時間のことです(物理学的半減期)。
半減期の長さは物質により異なり、長いほど物質の有効期間が長いと言えます。

次亜塩素酸は「水溶液」から揮発させることで、「気体状」の次亜塩素酸として存在することができます。気体状次亜塩素酸の半減期は実に50時間以上※1。
自己分解しにくい特性があり、遠くまで拡散することができます。



- ※1:当社調べ。次亜塩素酸技術の検証結果です。実使用空間・商品での試験結果ではありません。
- 試験条件:密閉の30Lガスバッグ内を所定の温湿度に保ち、気体状次亜塩素酸を充満させ、その濃度減衰の
時間推移を計測し、濃度が半減する時間を確認。 - 試験結果:各温湿度条件下において、いずれも50時間以上。
- ※2:出典:サンユー書房「オゾン利用浄化技術の実際」
※「次亜塩素酸ラボ」掲載の情報は、当社の技術研究成果もしくは研究中の内容であり、商品による効果ではありません。商品の効果・効能については、商品ページにてご確認ください。
